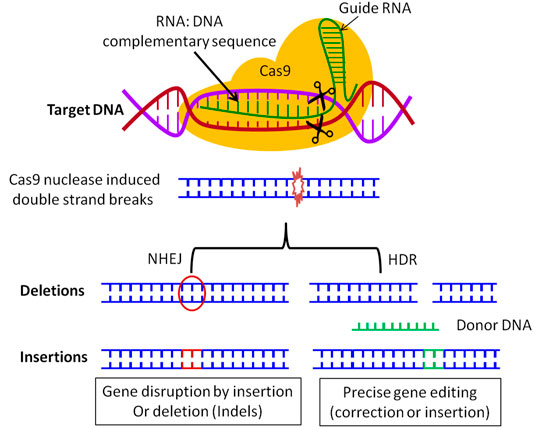
CRISPR-Cas9 系统利用短的合成引导 RNA 来指导 Cas9 酶在基因组中切割目标位置。通过 CRISPR-Cas9 敲除基因通常发生插入/缺失突变,其中单个引导 RNA(sgRNA)将 Cas9 引导到宿主基因组中的精确位置,Cas9 在基因组 DNA 中创建双链断裂(DSB)[1]。通过单个引导RNA(gRNA)引起的插入或缺失常用于产生敲除细胞,但是一些细胞通过跳过受扰乱的外显子或使用剪接变异体来表达目标基因,从而失去目标外显子[3]。为了克服目标基因的意外表达,几乎可以将整个基因与选择标记交换[2]。然而,创建一个包含 5'和 3'同源臂以及选择标记的靶向载体是耗时的。一种简单易行的方法称为 SUCCESS(Single-strand oligodeoxynucleotides, Universal Cassette, and CRISPR/Cas9 produce Easy Simple knock-out System)可用于在不构建靶向载体的情况下敲除目标基因[2]。该方法利用两个编码 Cas9 和 gRNA 的 pX330 质粒、两个80碱基单链寡脱氧核苷酸(ssODN)和一个钝端来删除目标大片段基因组区域[2]。
Aimsmass 提供以下 CRISPR-Cas9 基因敲除服务:
From quick startup to hands-on training, Aimsmass is here to help labs maximize efficiency and accelerate their progress.
查看高通量 CRISPR-Cas9 基因敲除是大规模发现和验证基因功能的有力方法。以下是优化高通量 CRISPR-Cas9 基因敲除的一些方法和指南:
CRISPR-Cas9 组件可以通过基于 DNA 的传递系统导入培养细胞,例如转染编码核靶向 Cas9 和 sgRNA 的质粒,或用病毒颗粒转导。
现有的指南和工具可用于优化 CRISPR/Cas9 基因组靶向效率和特异性,这将对基因组编辑实验的结果产生重大影响。
高通量 CRISPR-Cas9 基因敲除是选择哺乳动物细胞必需基因的一种很有前途的工具。
去看看 >
稳定敲除细胞系的产生是一个涉及细胞系中特定基因永久破坏的过程。Aimsmass 可提供敲除细胞系的建立服务,借助高通量我司所采取的高通量敲除手段,快速建立单克隆敲除细胞株。我们采取的是直接将 Cas9 蛋白与所需 gRNA 结合的核糖核蛋白(RNP)复合物导入细胞。RNP 的直接递送一方面加速了基因编辑动力学,另一方面减轻了由于 Cas9 快速降解而导致的脱靶效应。此外,由于 RNP 方法的无 DNA 性质,避免了潜在的转基因插入。
去看看 >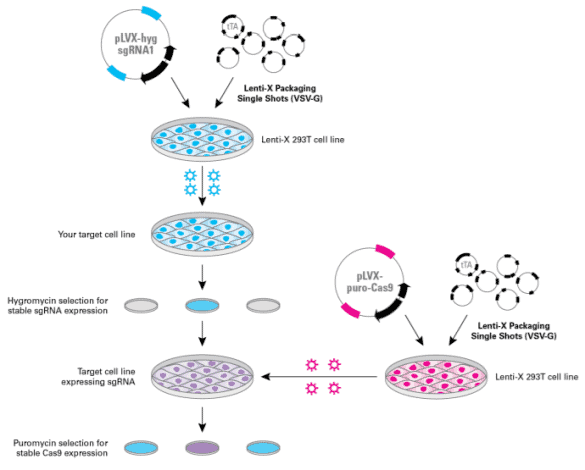
使用 CRISPR 技术可以实现稳定的敲低细胞系生成。产生稳定的敲低细胞系的一般步骤:设计 gRNA 构建:使用在线工具(如 CRISPR 设计工具)针对感兴趣的基因设计引导 rna(gRNAs)。
转染:用gRNA和Cas9质粒转染细胞,采用多种转染方法,如电穿孔、脂肪转染或核转染。
选择:转染后,选择细胞用于选择标记,如嘌呤霉素或潮霉素。这将选择已经吸收了质粒的细胞。
单克隆生成:利用有限稀释或流式细胞术将细胞低密度平板化生成单克隆。
筛选:使用各种方法筛选所需的敲低克隆,如 qPCR, western blotting 或免疫荧光。
验证:最后,使用功能分析验证敲除的细胞,以确认感兴趣的基因已被敲除。
Aimsmass为 gRNA 的设计、转染、选择和筛选提供了多种选择,能够及时、高效地生成稳定的细胞系。
去看看 >
敲除细胞池是用 CRISPR-Cas9 编辑过的异质细胞群,可以作为产生克隆敲除系的一种有吸引力的替代方法。敲除池是通过一次转染大量细胞而产生的,从而产生具有不同 indel 种群的异质编辑细胞池。单细胞分离可能是一个漫长而无回报的过程,在转染后使用池可能看起来是获得结果的快速途径。敲除细胞池是筛选和初步鉴定编辑细胞的理想选择[1]。
去看看 >