为了敲除目的基因,必须将核酸酶 Cas9 和靶标特异性向导 RNA 递送到细胞中。各种 CRISPR 平台适用于产生敲除,包括“多合一”或单质粒系统(其中 Cas9 和引导 RNA 编码在同一载体上),双质粒系统(其中 Cas9 和引导 RNA 编码在不同的载体上)和直接核糖核蛋白递送。
CRISPR/Cas9 系统是快速生成敲除细胞系的强大工具。很多敲除细胞系已经在最近的许多科研工作中被证明是有用的,允许科研人员确定未表征基因的功能,分析等基因背景中的敲除,并验证小分子抑制剂和 RNAi 构建体的活性。尽管如此,在大多数实验环境中生成和建立敲除细胞系时,我们需要考虑几个重要的因素。
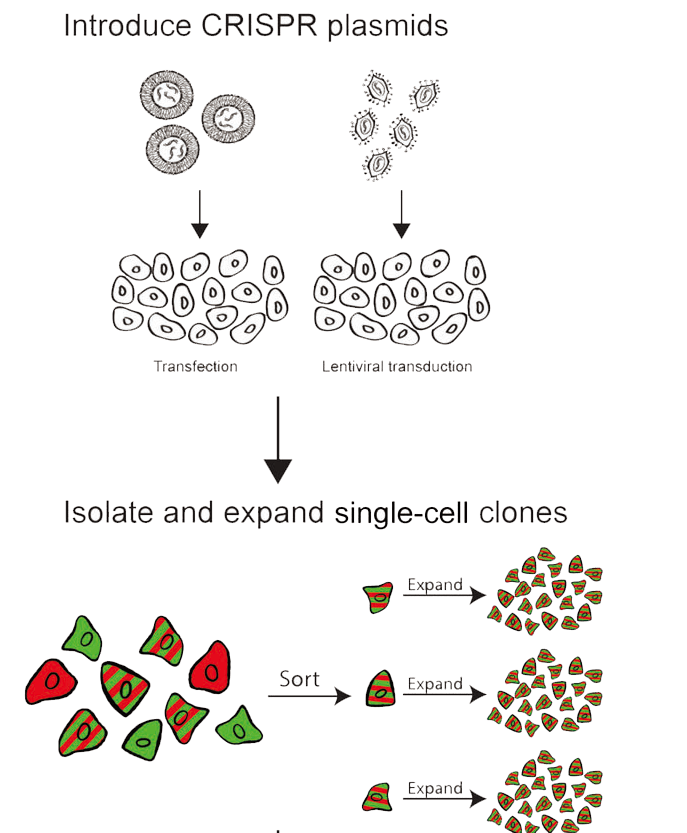
首先,重要的是要考虑单细胞分离前细胞群中可能存在的遗传、表观遗传和表型异质性。从单个细胞重新获得细胞系是一个重要的遗传瓶颈,如果单细胞衍生的克隆仅捕获起始细胞群中存在的多样性的一个子集,则实验可能会混淆。事实上,众所周知,一些已建立的细胞系表现出显着的克隆间异质性; 例如,来自广泛使用的 MDA-MB-231 乳腺癌细胞系的克隆之间的增殖能力存在相当大的差异。由于亲本异质性的可能性,分析多个独立的敲除细胞系以确保任何意外结果不是克隆伪影,这一点绝对至关重要。
其次,挑战单个细胞增殖以形成数百万个细胞的克隆群体代表了显着的选择压力。可以想象,这种压力可能会丰富不断增长的克隆中促进增殖的某些遗传和表观遗传改变。为了解释这种选择力,重要的是将实验敲除与在类似条件下获得的克隆“对照”细胞系进行比较。这些对照细胞还应携带靶向已建立的非必需位点的 Cas9 和/或 gRNA,以解释对 CRISPR 诱导的 DNA 损伤的任何非特异性反应。根据经验所知,与基因组中没有任何靶位点的指南相比,靶向已确认的非必要位点的指南具有轻微但显着的影响。
作为最小化细胞克隆影响或验证意外结果的替代方法,可以考虑在生成克隆敲除细胞系的同时进行批量 CRISPR 测定。在批量测定中,gRNA 可以通过转染或转导引入受体细胞系。如果有足够的细胞表达感兴趣的引导 RNA,则可以直接对该群体进行测定。
Aimsmass 可提供敲除细胞系的建立服务,借助高通量我司所采取的高通量敲除手段,快速建立单克隆敲除细胞株。我们采取的是直接将 Cas9 蛋白与所需 gRNA 结合的核糖核蛋白(RNP)复合物导入细胞。RNP 的直接递送一方面加速了基因编辑动力学,另一方面减轻了由于 Cas9 快速降解而导致的脱靶效应。此外,由于 RNP 方法的无 DNA 性质,避免了潜在的转基因插入。
|
细胞转染:优化细胞转染流程,导入 Cas9 RNP 复合物 基因编辑:导入复合物后,细胞中进行基因编辑 细胞分选:对导入基因的细胞进行分选 敲除验证:Sanger 测序进行验证 单克隆筛选:挑选单克隆细胞并进行验证 |
 |
服务流程 |
|