治疗性蛋白质是一种复杂的重组生物聚合物,通常由20个基因编码的氨基酸排列组成。氨基酸序列决定了蛋白质的三维结构和与相互作用的蛋白质的功能界面。在发酵、纯化、储存和处理以及强制降解研究过程中,蛋白质产品将经历多次降解。这些降解可能包括氨基酸侧链酶促或化学翻译后修饰(PTM)、聚集和蛋白水解裂解的组合卫生当局要求在生产过程中监测这些翻译后修饰和稳定性。因此,为量化这些PTMs而设计的选择性和稳健的分析方法的可用性是最重要的。广泛的分析技术可以在非GMP环境中广泛地表征重组蛋白,但可能需要后续的鉴定,并在产品上市时,根据人用药品注册技术要求协调国际会议(ICH)指南进行全面验证。
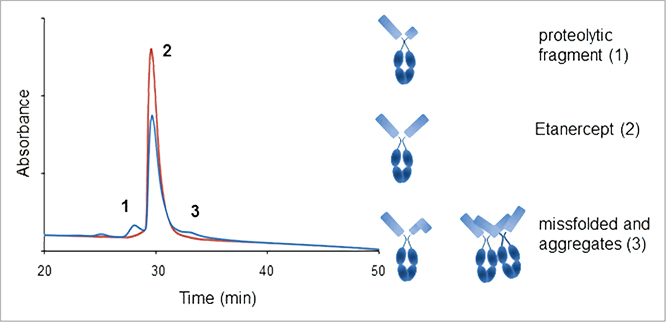
高效液相色谱(HPLC)已经是一种成熟的通过尺寸排除或离子交换来测定完整蛋白质的技术。然而,近年来反相色谱(RP)固定相(300A大孔径或短烷基链融合核颗粒)的技术发展,使其成为分析完整蛋白质的重要工具。高效液相色谱(HPLC)可以作为实时测量产品纯度的工具,从而大大提高了操作效率,减少了产品质量的可变性,从而实现自动化和控制。它在制药、化工和电子等工业领域的应用已经得到了广泛的证明。
色谱法是根据固定相和流动相的相对亲和度将混合物中各组分分离的过程。是他通过固体吸附剂柱发现了色谱法,他创造了色谱法这个术语,用来表示颜色化合物的分离。柱层析法是最常用的一种,将固定相放入柱中,然后泵送流动相。此外,由于其固有性质,高效液相色谱在生物分子分析中得到了广泛的应用。根据不同的理论,有不同的色谱方法正在被开发。高效液相色谱(HPLC)的基本程序是使用高压色谱柱处理样品,样品中包括流动相,由填充有适当基质的泵激励。分离是通过分子与柱基质的微分相互作用实现的,然后根据通过柱所需的时间进行分离。然后用合适的探测器对分离的分子信号进行检测,并在计算机系统上对数据进行处理。各种蛋白质在疏水性、电荷、生物亲和和大小等方面的微小差异,发展了一些基本类型的色谱技术,这些方法的不同主要在于用于实现蛋白质分子分离的固定相类型。
液相色谱(LC)方法已成功地用于监测单克隆抗体的含量、纯度、鉴别和化学稳定性。鉴于单克隆抗体的大分子性质,高效液相色谱法(SE-HPLC)也被用于定量和确定天然大小,并揭示在表达、纯化和加工以及储存和给药过程中可能形成的聚集物。反相高效液相色谱法(RP-HPLC)是一种高精度的液相色谱法以及相关蛋白变异或降解产物分析的灵敏技术。单克隆抗体可在过氧化或光胁迫条件下诱导氧化,导致疏水性降低,并可被反相高效液相色谱分离。
实验流程 |
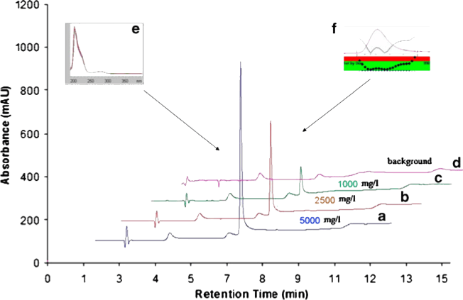
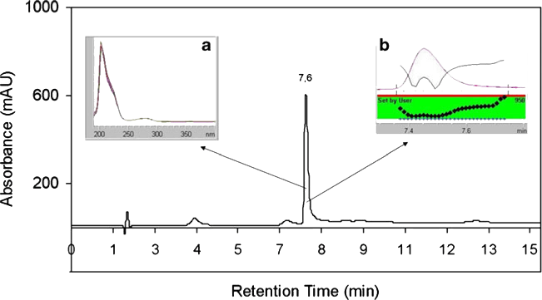
标准品色谱图 | 样品的色谱图 |
 |
 |
服务流程 |
|