翻译后蛋白修饰是共价修饰,通常是蛋白的酶修饰和在生物合成过程中的蛋白加工。翻译后修饰增加蛋白组功能多样性,通过修饰蛋白的功能集团例如磷酸集团,乙酰基集团,酰胺基集团或者甲基集团,几乎影响整个细胞生物学和发病机理的过程。修饰包括磷酸化,糖基化,泛素化,亚硝基化,甲基化,乙酰化和脂化等。
服务优势
高精度高分辨质谱:采用Thermo Fisher质谱仪,对修饰肽段进行检测,可找出肽段准确修饰位点,并提供具体修饰位点谱图信息。
简单快速便捷:仅需准备足量蛋白,可同时一次分析3种修饰,实验前准备简单,周期短,约一周可得蛋白修饰位点。
可检测修饰种类多:只需知道具体修饰集团分子量即可对蛋白该修饰进行研究探索。
主要的蛋白修饰类型
From quick startup to hands-on training, Aimsmass is here to help labs maximize efficiency and accelerate their progress.
查看SUMOylation是一种翻译后修饰,涉及各种细胞过程,例如核-细胞质转运、转录调控、细胞凋亡、蛋白质稳定性、对压力的反应以及通过细胞周期。SUMO 蛋白与泛素相似,被认为是泛素样蛋白家族的成员。蛋白质的SUMO修饰具有许多功能。其中最常见和研究最多的是蛋白质稳定性、核-胞质转运和转录调控。通常,给定蛋白质中只有一小部分被 SUMO 化,并且这种修饰会通过去SUMO 化酶的作用迅速逆转。
去看看 >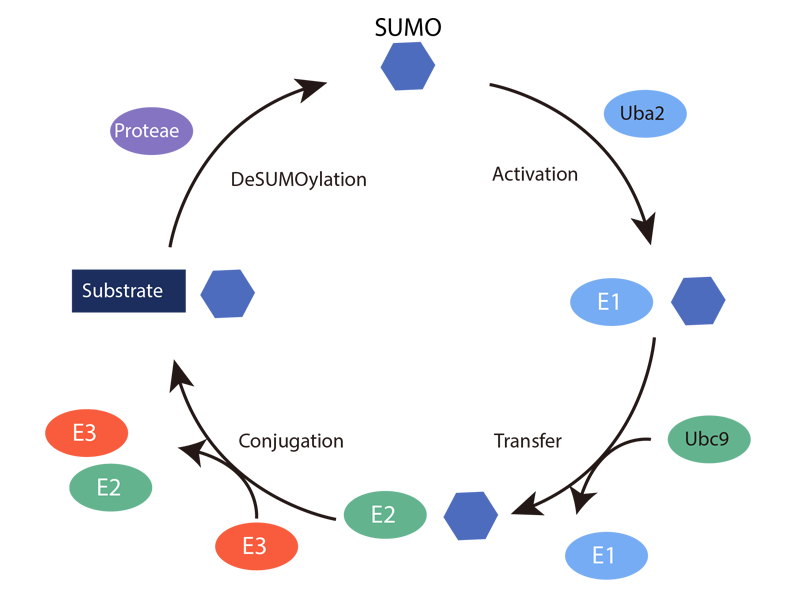
S-亚硝基化,即一氧化氮基团与半胱氨酸硫醇侧链的共价连接,已成为大多数或所有主要蛋白质类别的动态翻译后调节的重要机制。S-亚硝基化因此传达了一氧化氮 (NO) 对细胞信号转导的普遍影响的很大一部分,并为基于氧化还原的生理调节提供了机制。S-亚硝基化调节作为广泛关键功能基础的细胞机制,包括细胞凋亡、细胞代谢、膜运输、蛋白质磷酸化、通过变构和活性位点修饰的酶活性、转录因子稳定性和活性、受体偶联和其他离子通道活性,以及维持细胞氧化还原平衡(对氧化和亚硝化应激的反应)。S-亚硝基化生理作用的阐明已经开始影响对人类健康和疾病的理解,S-亚硝基化的失调与越来越多的病理生理状况(内毒素休克、多发性硬化症、帕金森病、肺高血压、镰状细胞病和哮喘)。-亚硝基硫醇(SNO),这一过程通常被称之为S-亚硝基化作用。被大家公认的是蛋白发生S-亚硝基化的调控与磷酸化类似,尽管蛋白中的半胱氨酸残基都可发生S-亚硝基化修饰,但是只有很少的修饰是特异性的并且起到调控蛋白功能的作用。
去看看 >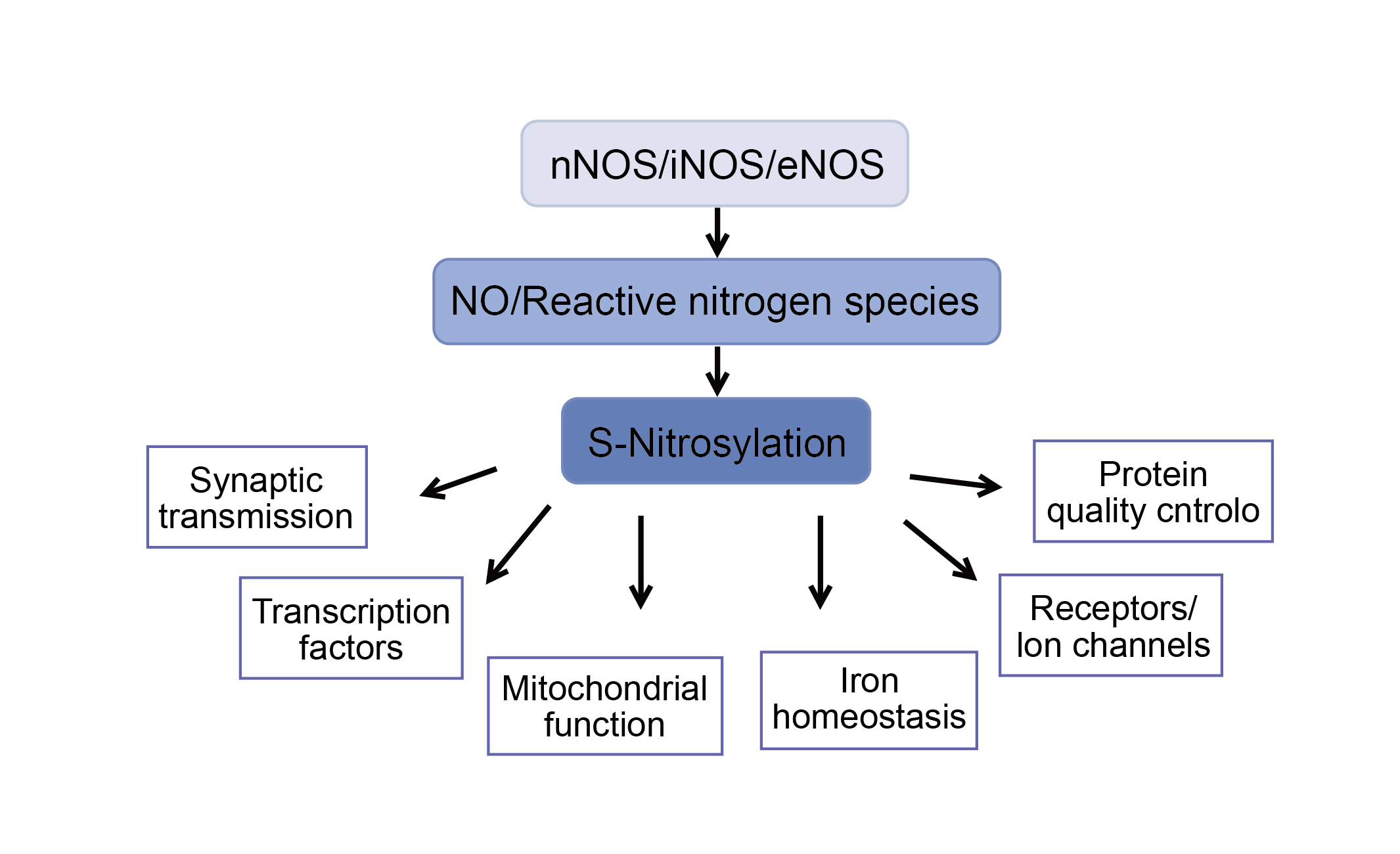
二硫键的形成涉及两个半胱氨酸残基的巯基 (SH) 侧链之间的反应:来自一个巯基的 S-阴离子充当亲核试剂,攻击第二个半胱氨酸的侧链以产生二硫键键,并在此过程中释放电子(还原当量)进行转移。适当的二硫键为蛋白质提供稳定性。目前可以通过质谱手段分析蛋白二硫键的结合方式以及对应的发生位置。
去看看 >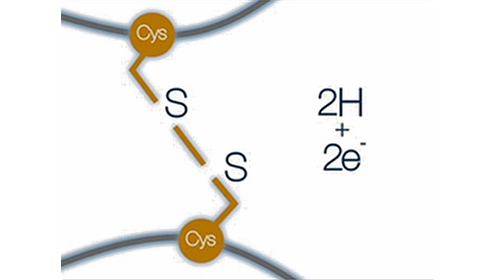
泛素是在真核生物的大多数组织中发现的小 (8.6 kDa )调节蛋白,向底物蛋白添加泛素称为泛素化(或者,泛素化或泛素化)。泛素化以多种方式影响蛋白质:它可以通过蛋白酶体标记它们进行降解,改变它们的细胞位置,影响它们的活性,并促进或阻止蛋白质相互作用。通过将泛素化位点富集与连续 LysC 和胰蛋白酶消化以及高精度 MS 相结合,可以鉴定出来泛素化在蛋白上的修饰位点。
去看看 >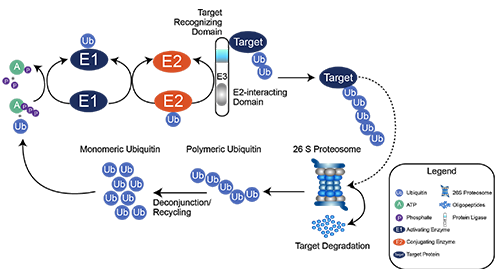
γ- L-谷氨酰-L-半胱氨酰-甘氨酸主要被称为谷胱甘肽(GSH),是与硫醇-氧化还原状态的维持和调节的改变相互关联的几个细胞过程所必需的,因为它能够存在于不同的氧化还原物质中。在生理条件下,还原型 GSH 是主要形式,其浓度比氧化型(氧化型 GSH,GSSG 和混合二硫化物,GSSR)高 10 到 100 倍。GSSG 主要通过 GSH 过氧化物酶 (GPX) 的催化以及 GSH 与亲电子化合物(例如自由基物质)的直接反应产生。相反,GSSR 的生产需要“反应性”半胱氨酰残基,其在生理 pH 值下以硫醇盐形式存在。这些残基在氧化应激下容易在次磺酸中氧化,次磺酸与 GSH 有效反应,生成谷胱甘肽化半胱氨酸衍生物 (GSSR)。GSSG 和 GSSR 都可以分别通过 NADPH 依赖性 GSH 还原酶和硫氧还蛋白 (Trx)/谷氧还蛋白 (Grx) 系统催化还原回 GSH。此外,GSSG 和 GSSR 之间可能会发生非酶促相互转化。通过蛋白质-S-谷胱甘肽化可逆形成混合二硫键 GSSR是动态翻译后调节各种参与信号传导和代谢途径的调节、结构和代谢蛋白的重要开/关机制。
去看看 >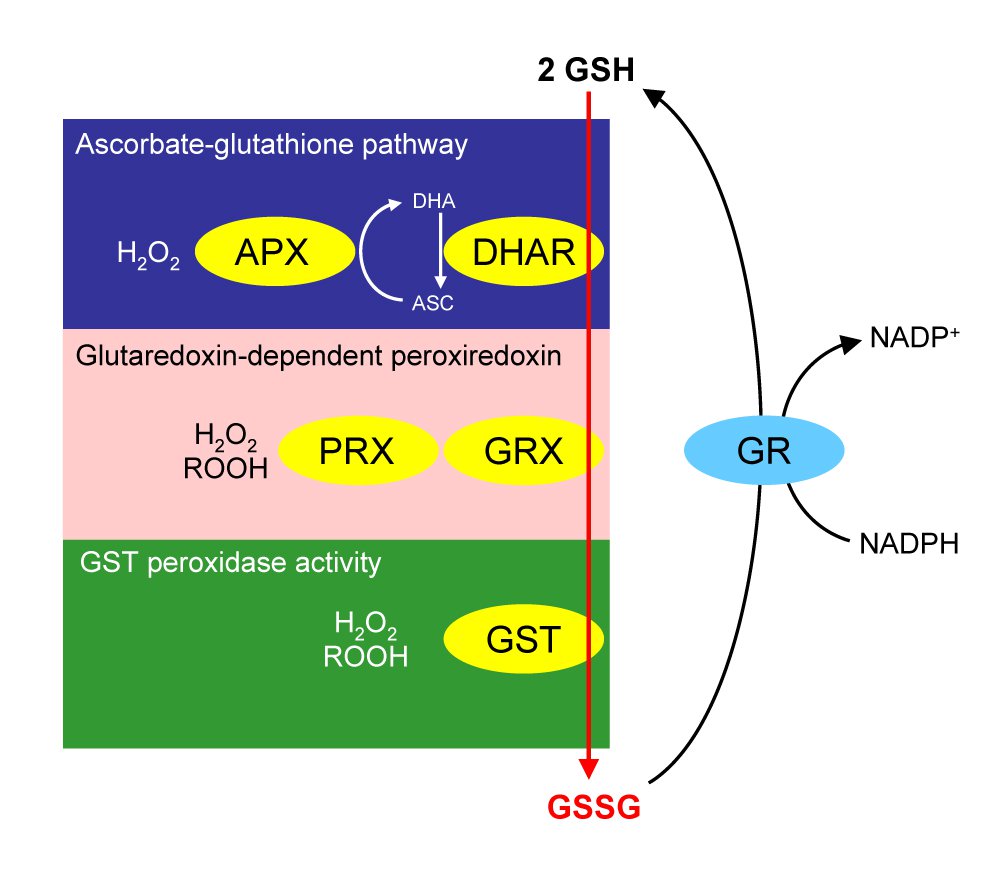
蛋白质磷酸化是可逆的翻译后修饰,其中蛋白的氨基酸残基被磷酸化由蛋白质激酶通过添加共价结合的磷酸盐基团;磷酸化的逆反应称为去磷酸化,由蛋白磷酸酶催化。蛋白激酶和磷酸酶独立并平衡地调节蛋白质的功能。磷酸化改变蛋白质的结构构象,使其活化、失活或改变其功能。最常被磷酸化的氨基酸是真核生物中的丝氨酸、苏氨酸、酪氨酸,以及原核生物和植物中的组氨酸(尽管现在已知它在人类中很常见)。这些磷酸化在信号通路和代谢中发挥着重要且特征鲜明的作用。然而,其他氨基酸也可以在翻译后磷酸化,包括精氨酸、赖氨酸、天冬氨酸、谷氨酸和半胱氨酸,并且最近使用基于抗体的分析(针对 pHis)和质谱法(针对所有其他氨基酸)的组合,发现这些磷酸化氨基酸存在于人类细胞提取物和固定的人类细胞中。
去看看 >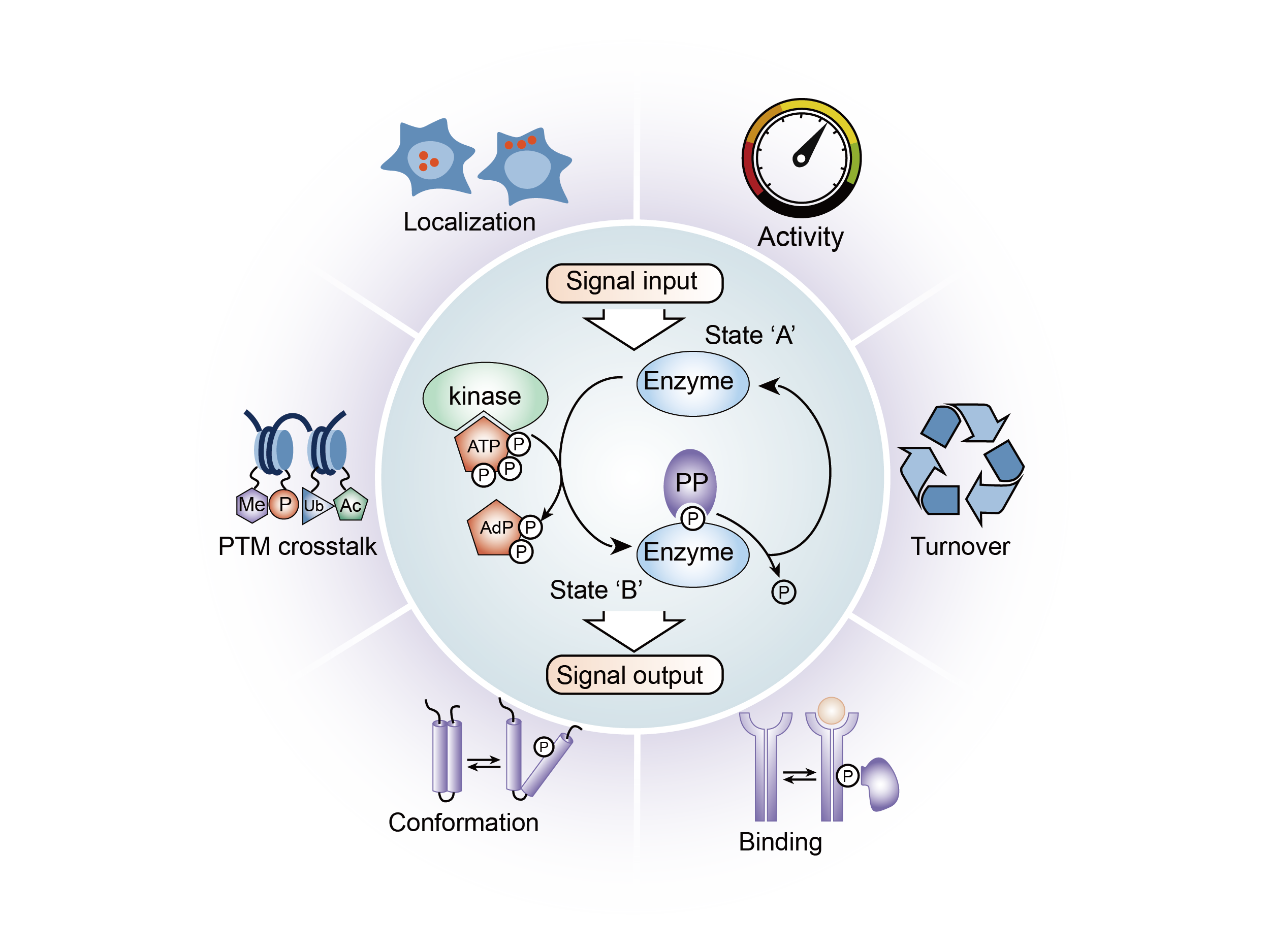
蛋白质乙酰化是另一种非常常见的蛋白质修饰。首先在组蛋白中广泛研究了蛋白质的赖氨酸乙酰化和脱乙酰化,它是由赖氨酸乙酰转移酶(KAT,以前称为 HAT、组蛋白乙酰转移酶)和脱乙酰酶(KDAC,通常称为组蛋白脱乙酰酶或 HDAC)。乙酰化和去乙酰化之间的相互作用对于许多病毒细胞过程很重要,KAT 和 KDAC 的调节和/或功能的任何扰动都可能与神经退行性疾病、癌症、衰老、糖尿病、心血管疾病和自身免疫性疾病等疾病有关。乙酰化作为蛋白质的共翻译和翻译后修饰发生,例如组蛋白、p53和微管蛋白。在这些蛋白质中,染色质蛋白和代谢酶的代表性很强,表明乙酰化对基因表达和代谢有相当大的影响。在细菌中,90% 的蛋白质参与中枢代谢沙门氏菌是乙酰化的。
去看看 >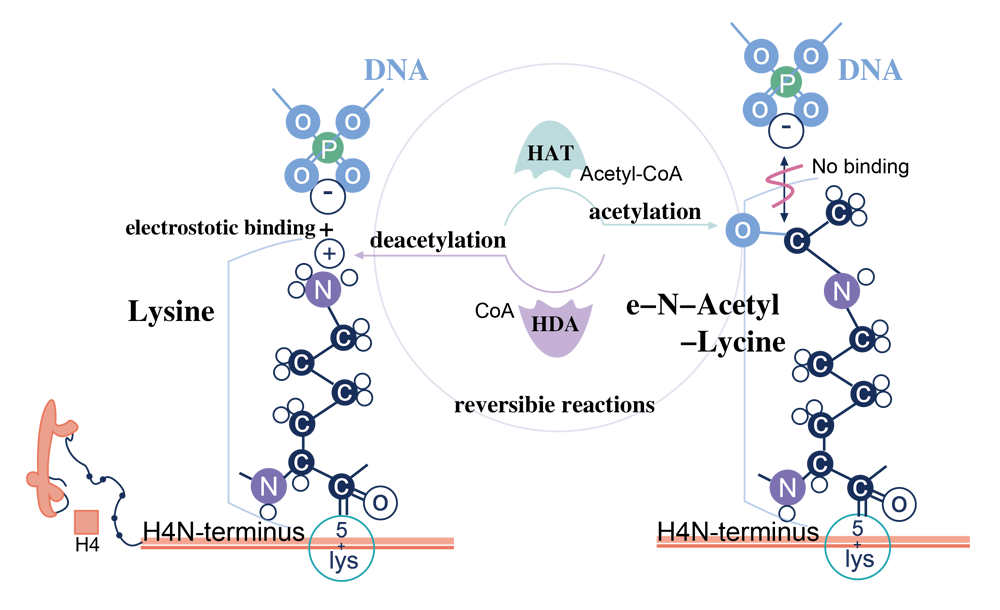
异戊烯化(也称为异戊二烯 或脂化)是增加的疏水性分子的蛋白或化学化合物。蛋白质异戊二烯化涉及将法呢基或香叶基香叶基部分转移到目标蛋白质的C 端半胱氨酸。在细胞中进行异戊二烯化的酶有三种:法呢基转移酶、Caax 蛋白酶和香叶基香叶基转移酶 I。法呢基化是异戊二烯化的一种,是蛋白质的翻译后修饰,通过将异戊二烯基团添加到半胱氨酸残基。它是介导蛋白质-蛋白质相互作用和蛋白质-膜相互作用的重要过程。
去看看 >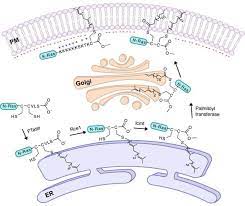
蛋白质甲基化是一种翻译后修饰,其特征是向蛋白质添加甲基。它可以发生于的含氮侧链精氨酸和赖氨酸,而且在许多不同的蛋白质的氨基和羧基末端。在生物学中,甲基转移酶催化甲基化过程,主要由S-腺苷甲硫氨酸激活。蛋白质甲基化在组蛋白中得到了最多的研究,其中甲基从 S-腺苷甲硫氨酸的转移被催化组蛋白甲基转移酶。在某些残基上甲基化的组蛋白可以通过表观遗传来抑制或激活基因表达。通过联合酶切与质谱手段,可以检测出具体对应蛋白的甲基化修饰位点。
去看看 >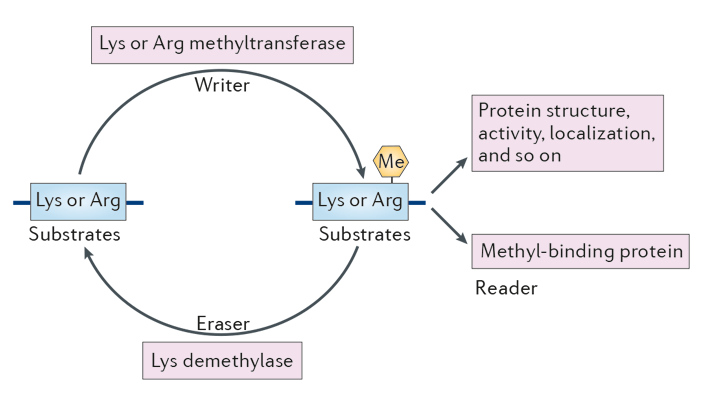
蛋白质棕榈酰化是一种经典且常见的脂质修饰,可调节神经元蛋白质运输和功能的各个方面。棕榈酰化的可逆性质为细胞内隔室之间的蛋白质穿梭提供了一种潜在的通用机制。最近发现的棕榈酰化酶——一个大的 DHHC (Asp-His-His-Cys) 蛋白家族——以及新蛋白质组学和成像方法的发展加速了棕榈酰化分析。棕榈酰化是脂肪酸(例如棕榈酸)与半胱氨酸(S-棕榈酰化)的共价连接,较少与蛋白质的丝氨酸和苏氨酸(O-棕榈酰化)残基共价连接,这些蛋白质通常是膜蛋白。棕榈酰化的精确功能取决于所考虑的特定蛋白质。棕榈酰化增强了蛋白质的疏水性并有助于它们的膜结合。棕榈酰化似乎也在膜隔室之间的蛋白质亚细胞运输中发挥重要作用,以及调节蛋白质-蛋白质相互作用。与异戊二烯化和肉豆蔻酰化相反,棕榈酰化通常是可逆的(因为棕榈酸和蛋白质之间的键通常是硫酯键)。在逆反应的哺乳动物细胞中通过催化酰基蛋白硫酯酶(APT中)在胞质溶胶和棕榈酰蛋白硫酯酶在溶酶体. 因为棕榈酰化是一个动态的翻译后过程,据信它被细胞用来改变亚细胞定位、蛋白质-蛋白质相互作用或蛋白质的结合能力。
去看看 >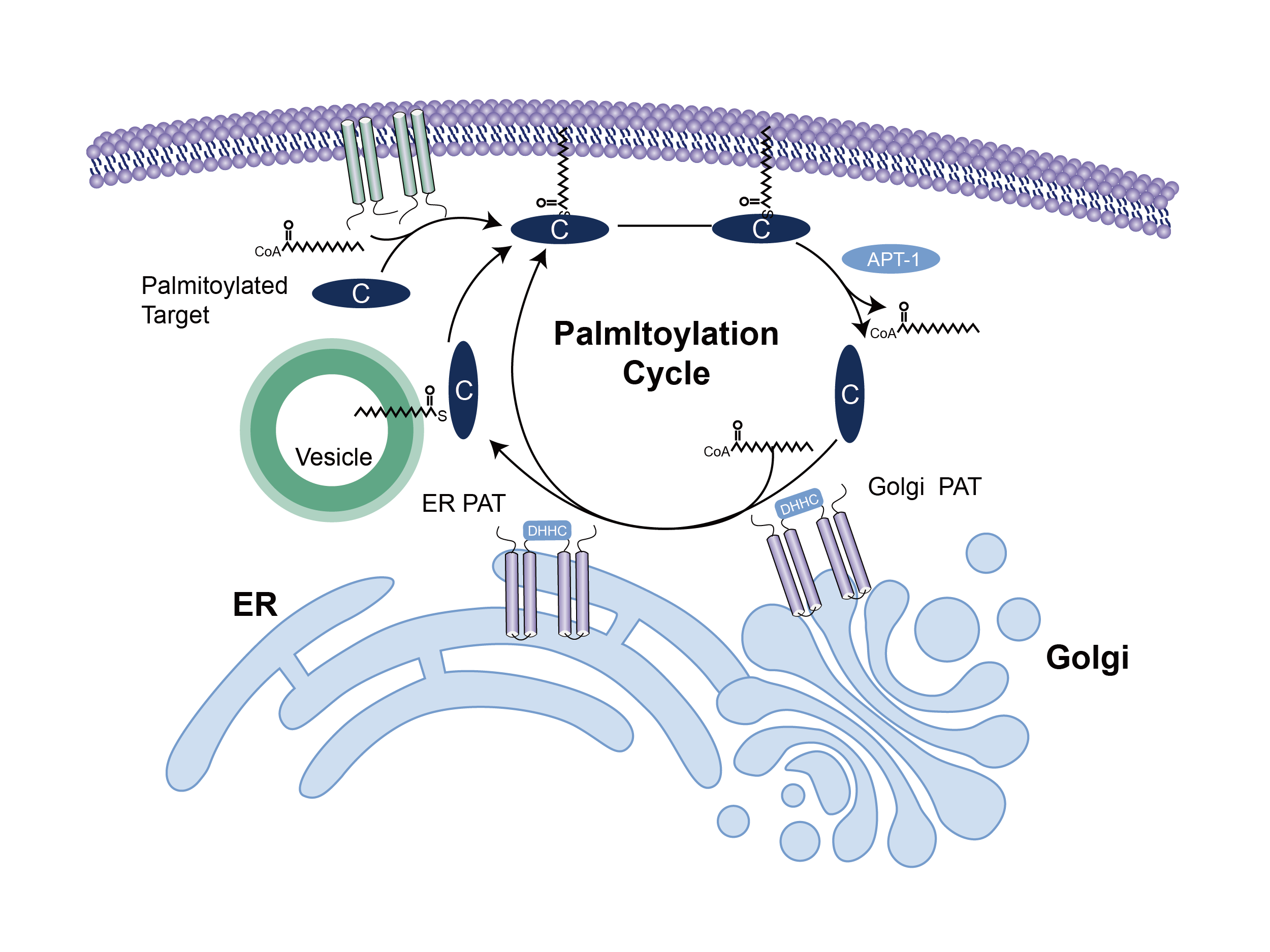
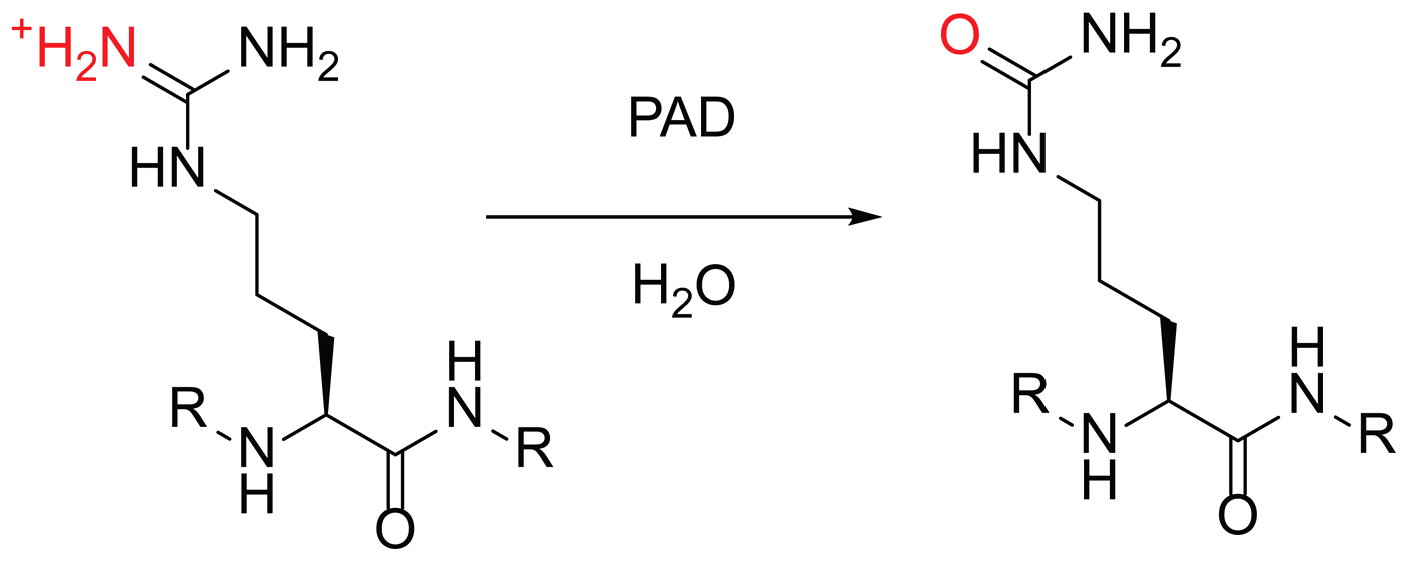
蛋白瓜氨酸修饰是最为广泛,研究最为深入的蛋白翻译后修饰之一,在细胞生理学中扮演着至关重要的作用。磷酸化过程在生物体中是可逆的,并且通过蛋白激酶和蛋白磷酸酶在真核和核生物中起着磷酸化调控的作用。据估计细胞中1/3的蛋白同时发生磷酸化,所有的生命过程都通过此修饰直接或者间接的进行调控。
去看看 >