小泛素化修饰(SUMO)是通过E1,E2和E3三种酶调控的酶级联反应将其连接在底物上。Ubc9E2酶的活性部位,通过识别底物上特定的共识四肽序列ѱKXE(ѱ,疏水氨基酸; K, 目标赖氨酸, X, 任意氨基酸, and E, 谷氨酸),并与其发生连接反应。迄今为止,SUMO化受体位点通过目标氨基酸残基上的共识四肽序列被广泛识别。
通过近期的蛋白质组学研究表明,相当比例的SUMO化蛋白不包含共识位点,并且不能通过传统突变方法获得。此外,还有方法提出一种非共识的SUMO靶向模型,其中SUMO-Ubc9的硫酯集团被位于底物上的SUMO相互作用基序(SIM)所募集。然而,针对靶向非共识底物的机制仍然未明确。因此需要能够无偏倚鉴定SUMO化修饰位点的新方法。
胰蛋白消化的哺乳动物SUMO化修饰蛋白,在目标赖氨酸残基上产生了较长侧链的一段肽段序列(图1A),目前常用的蛋白质组学手段,并不能很好的应用于这些分支肽段序列的鉴定,相比较线性多肽比较,在质谱中呈现较高度复杂的片段化模式。
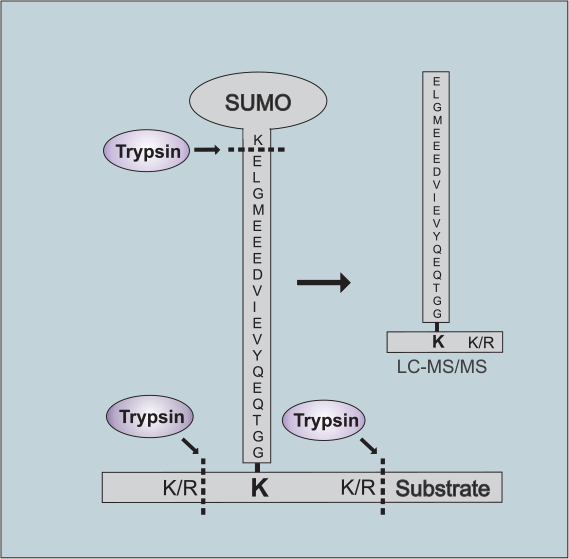
图1
解决这一个问题的方法是在SUMO-1蛋白的C末端进行苏氨酸-精氨酸替代(T95R),精氨酸残基导致长侧链被胰蛋白酶水解,而赖氨酸残基上有两个甘氨酸残基作为标志性标签(114.0429Da),它代表了SUMO化修饰位点集团。由于检测灵敏度低,且缺乏针对复杂胰蛋白酶消化系统中含SUMO化位点的特异性纯化寄出,因此该方法具有较大问题和挑战性。
为了便于在体内识别SUMO化修饰位点,下面有报道开发了一种新的组合策略,使用进一步重组的SUMO-1蛋白。
除了易于检测的标签,该策略还具有富集SUMO化肽段的能力。在Hela细胞中应用这种底物无偏倚的方法,最后鉴定到了共识和非共识的SUMO化位点,提供了一种SUMO化修饰位点的鉴定的新手段。
为了便于在体内鉴定到蛋白的SUMO化位点,开发了一种基于改良的半胱氨酸标记形式的SUMO化蛋白富集手段。(图1B)
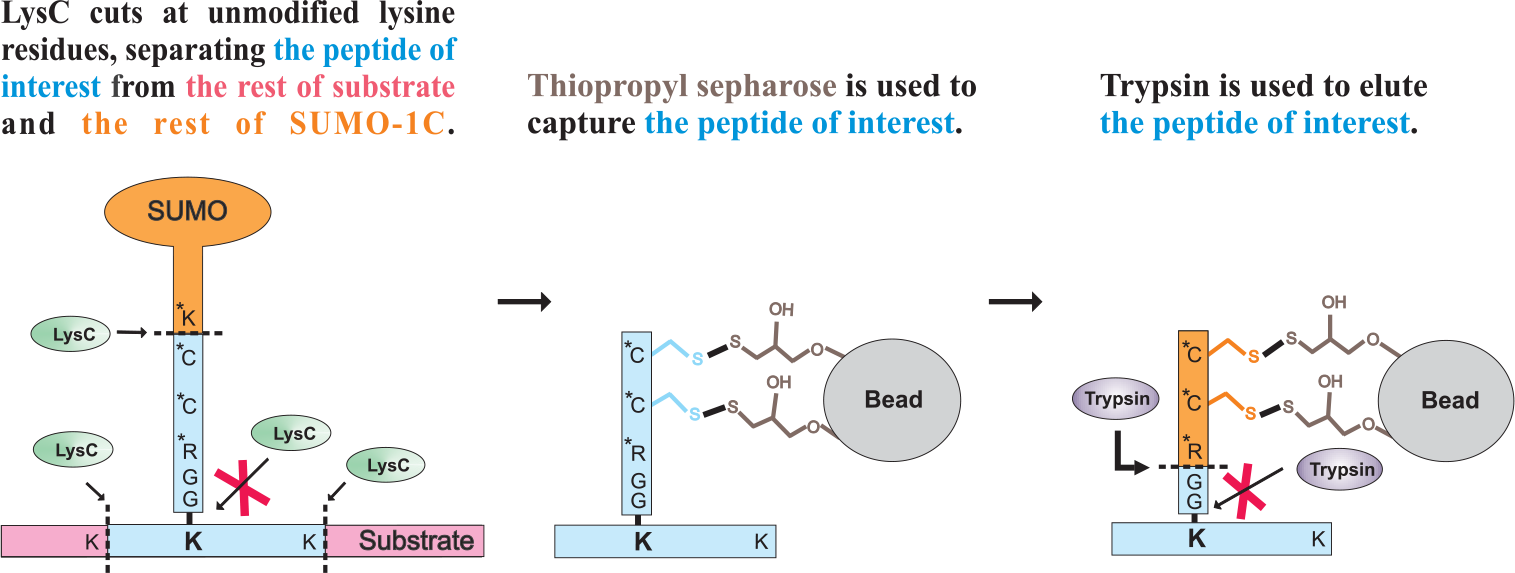
图1B
通过使用两种不同的蛋白酶,LysC酶可以使蛋白消化后以富含半胱氨酸为支链,可以通过与巯基特异性树脂(Thiopropyl-Sepharose 6B)的共价结合而被特异性保留。而通过胰蛋白酶则总固定半胱氨酸标签中释放出目标肽段。结果在赖氨酸残基上获得了含有两个额外质量的甘氨酸残基的肽段,从而可以用质谱方法鉴定SUMO化修饰位点。
这里所采取富集方法使用了可去除的胱氨酸标签,大大提高体内的SUMO化位点鉴定的可能性。类似于磷酸化肽段富集可使磷酸化蛋白质组学发展的情况,对于SUMO化修饰肽段的富集,同样可能拓展SUMO化修饰蛋白组学的研究领域。
综上所述,此方法是一种有效研究SUMO化修饰位点的新思路,并且这种方法可以应用于各种研究领域,它的开发将有利于解开SUMO修饰的机制以及识别不同SUMO修饰类型。
文献出处:Proteome-wide identification of SUMO modification sites by mass spectrometry
Aimsmass---蛋白质谱服务,提供快速便捷的SUMO化位点鉴定服务