周期性棕榈酰化调节小鼠TLR9信号传导和全身自身免疫
Toll样受体9(TLR9)识别自身DNA并在系统性红斑狼疮(SLE)中发挥复杂的作用。然而,调控内体TLR9反应的分子机制还不清楚。在这里,我们报道了棕榈酰蛋白硫酯酶1(PPT1)通过去除溶酶体TLR9中的s-棕榈酰化来调节全身自身免疫。PPT1促进浆细胞样树突状细胞(pDCs)分泌IFNα和巨噬细胞分泌TNF。遗传缺陷或化学抑制PPT1降低抗核抗体水平,减轻B6Sle1yaa小鼠的肾炎。在健康志愿者和SLE患者中,PPT1抑制剂HDSF可在体外减少IFNα的产生。机制、生化和质谱分析表明,TLR9在C258和C265位点被s-棕榈酰化。此外,蛋白酰基转移酶DHHC3棕榈酰化高尔基体中的TLR9,并调节TLR9转运到核内体。随后PPT1的去棕榈有丝分裂化促进TLR9从UNC93B1释放。我们的研究结果揭示了一个控制TLR9反应和自身免疫的翻译后修饰周期。
s-棕榈酰化是一种可逆的翻译后修饰,其中半胱氨酸残基共价连接到饱和C16脂质棕榈酸。棕榈酰化状态有助于蛋白质结构和稳定性、囊泡运输和膜稳定性。一个大的DHHC蛋白酰基转移酶家族可以s-棕榈酰化高尔基体、细胞质或细胞膜中的蛋白。几种类型的水解酶,如酰基蛋白硫酯酶和棕榈酰蛋白硫酯酶,可以分别使细胞质或溶酶体中的蛋白去棕榈酰化。在免疫系统中,棕榈酰化循环已被证明对几个关键的细胞通路和免疫过程(如STAT3、MYD88或NOD1/2信号通路)和免疫过程(如PD-L1降解和抗原cross-presentation47,54–57)具有重要作用。然而,棕榈酰化在自身免疫性疾病(如SLE)中的重要性尚未得到证实。
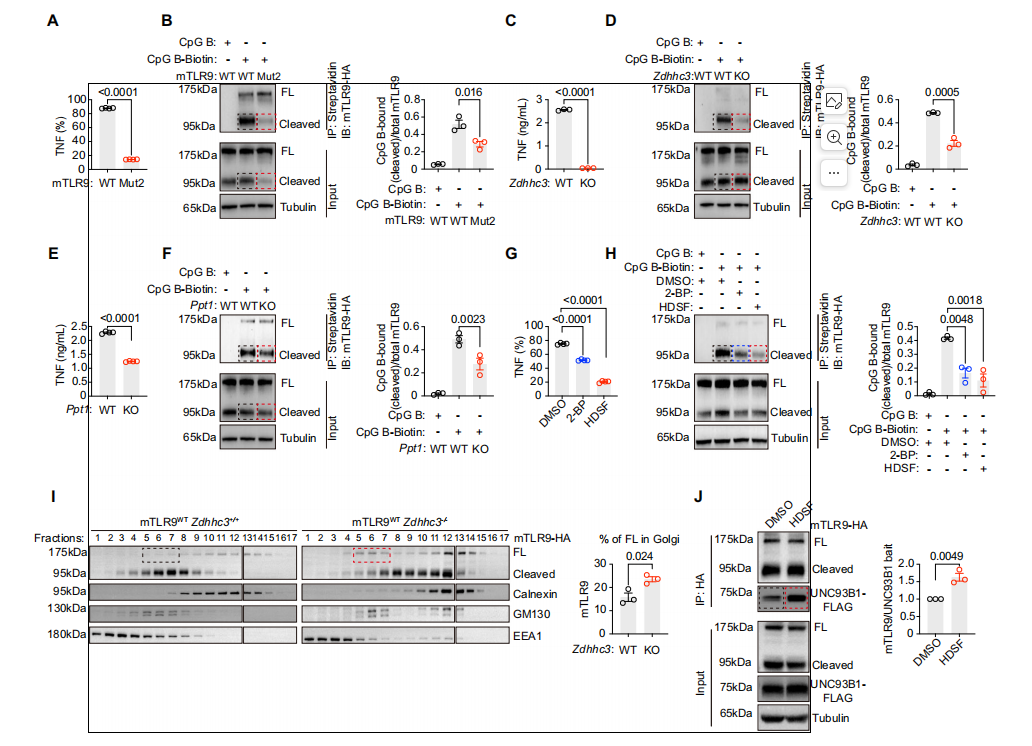
在这项研究中,我们发现s-棕榈酰化调节PDCS和巨噬细胞的TLR9反应。TLR9在外域携带至少两个s-棕榈酰化位点。棕榈酰化循环始于高尔基体,DHHC3棕榈酰化TLR9,并在溶酶体中结束,PPT1去棕榈酰化TLR9。TLR9棕榈酰化循环直接调节PDCS和巨噬细胞的配体结合和细胞因子分泌。因此,在转基因SLE小鼠模型中,PPT1基因缺陷或PPT1抑制剂可降低自身抗体水平并减轻肾炎。棕榈酰化抑制剂也抑制SLE患者PDCS产生IFNα。我们的研究概述了一种调节TLR9反应的翻译后修饰机制,并提出了治疗自身免疫性疾病的潜在免疫治疗靶点。TLR9在人和小鼠中棕榈酰化。此外,我们发现TLR9的棕榈酰化和去棕榈酰化是由高尔基驻地DHHC3和溶酶体驻留的PPT1分别介导。这种棕榈酰化循环调节了PDCS、B细胞和巨噬细胞中细胞因子的产生。我们还证明了TLR9棕榈酰化循环在体内SLE小鼠模型中的重要性。
我们的研究结果表明,TLR9的配体结合受内体棕榈酰化周期的调节。我们利用多种生化方法,如click化学、ABE测定和质谱分析,证明人和小鼠TLR9是s-棕榈酰化的。Click化学和ABE测定只能预测蛋白质的棕榈酰化状态。我们发现TLR9在lrr之间的小环上棕榈酰化。这种模式表明棕榈酰化氨基酸可能直接或间接地促进CpG配体的结合。然而,没有一个潜在的棕榈酰化位点位于CpG结合z环。棕榈酰化已被证明对膜相关蛋白(如RabGTPases85)的内体运输很重要。除了配体结合和受体运输,TLR9下游信号适配器(如MYD88)棕榈酰化水平的变化可能有助于我们观察到的表型,特别是在使用棕榈酰化抑制剂的实验中。最后,先前对棕榈酰化蛋白的研究一致地发现只有一个或两个半胱氨酸残基作为s-棕榈酰化位点。然而,我们的两个点突变(Mut2)在ABE检测中并没有完全消除TLR9棕榈酰化。这表明TLR9可能有额外的棕榈酰化位点。综上所述,s-棕榈酰化可能同时调控TLR9和TLR7转运、膜稳定性和下游信号通路。
棕榈酰化分析
点击化学分析:细胞用100µM叠氮棕榈酸(Click-iT棕榈酸叠氮)(赛默飞世尔科学公司,C10265)在完全的DMEM中处理,然后在37°C下5%CO2下孵育6小时。孵育后,去除培养基,细胞用磷酸盐缓冲盐水洗涤三次,然后加入含有蛋白酶抑制剂混合物的裂解缓冲液(赛默飞世尔科学公司,78443)。不溶性物质通过离心从含蛋白的细胞裂解物中去除。使用BCA测定法测定蛋白质浓度(Beyotime,P0012)。将100μg的蛋白质转移到新鲜试管中。使用Click-iT蛋白质反应缓冲试剂盒(赛默飞世尔科学公司,C10276),将200μg叠氮化物标记的蛋白质样品与生物素-炔反应,按照制造商说明书上的方案进行反应。然后,生物素炔-叠氮-棕榈-蛋白复合物被链亲和素-琼脂糖珠拉下(赛默飞世尔科学公司,20361)。。洗涤后,将样品重新悬于0.2ml的2倍还原SDS-PAGE样品缓冲液中,在95℃下煮沸10分钟。
酰基-生物素交换(ABE)
样品悬浮在含有蛋白酶抑制剂混合物(赛默飞世尔科学,78443)和50mM n-乙基马来酰亚胺(Sigma,E3876)的1 ml裂解缓冲液(赛默飞世尔科学,87787)中,在4°C下孵育过夜。样品用氯仿/甲醇沉淀,短暂风干,重悬于1ml复液中(50 mM Tris-HCl,pH 7.2;2% SDS;8 M 尿素;5 mM EDTA)。然后将样品分成2种溶液;1等分液与0.5 mL 1m羟胺(Macklin,H811237)配伍,阴性对照与0.5mL1M NaCl配伍。样品在RT孵育1小时,然后用氯仿-甲醇处理沉淀蛋白质。将蛋白颗粒重悬于含有10μl Mex-link HPDP-Biotin(赛默飞世尔科学,21341)的1ml重悬缓冲液中,RT-孵育2小时。通过氯仿-甲醇沉淀法去除多余的生物素。蛋白球溶解于0.25mL重悬缓冲液中。BCA法测定蛋白质浓度。将100μg的蛋白质转移到新鲜试管中作为“输入”。取800μg蛋白质溶液,用PBS1:10稀释,与20µL链亲和素琼脂糖珠(赛默飞世尔科学公司,20361)混合1h,用含有1%SDS的PBS洗涤3次。珠结合样品被标记为“输出”,并在0.2ml的2倍还原SDS-PAGE样品缓冲液(Sigma,S3401)中重悬。在SDS-PAGE之前,样品在95°C下煮沸10分钟。
质谱分析
先前描述了ABE样品制备。携带mTLR9-Flag的RAW264.7细胞被裂解、溶解,并用抗flag亲和珠进行免疫沉淀(Sigma,A2220)。在4°C下用1ml裂解缓冲液洗涤三次后,根据制造商说明书上的方案,使用IP-ABE Palmitoylation Kit for MS(Aims,AM10417)进行ABE分析制备程序和烷基化反应。洗脱的样品用于进一步的MS分析。样品经胰蛋白酶酶切成多肽后,采用赛默飞世尔科学(Thermo Fisher Scientific)纳米流UPLC系统和Q萃取混合四极轨道阱质谱仪(赛默飞世尔科学)进行液相色谱-串联质谱分析。多肽混合物在Easy-nLC1200系统上分离,C18纳米柱(3μm,75μm×15cm,自制),流速为600nL/min。建立66分钟的线性梯度如下:2分钟4%B到8%B,43分钟8%B到28%B,10分钟28%B到40%B,1分钟40%B到95%B,并在95%B保持10分钟。为了获取数据,使用前20种扫描模式,MS扫描范围为m/z300-1800。为了更好地识别修饰的氨基酸位点,每个前体离子用HCD碎片化。将HCD的碰撞能设为28,并根据各前驱体的m/z和离子荷态自动设定ETD反应时间。使用Byonic(Version4.3)软件对原始MS文件进行分析,并根据样本物种对目标蛋白数据库进行检索。参数设置如下:蛋白质修饰为氨基甲基化(C)(+57.0215)、乙酰化(蛋白质n项)(变量)、氧化(M)(变量)和棕榈酰化(C、K、S、T,蛋白质n项)(+238.230);酶特异性设置为胰蛋白酶;最大缺失切割数设置为3;前驱体离子质量toltolerance设为20ppm,MS/MS tolerance设为20ppm。下游蛋白鉴定分析只选择高置信度鉴定的肽段。
客户发表文献原文链接:https://pubmed.ncbi.nlm.nih.gov/38169466/
Aimsmass---蛋白质谱服务,提供快速便捷的棕榈酰化修饰位点鉴定服务
https://www.aimsmass.com/products/AM10417.html