生命系统适应变化条件的能力源于它们改变分子结构的能力。这是通过多种机制实现,例如调节分子数量组成和分子种类多样性。分子多样性在蛋白质组水平上尤其明显,来自同一基因的多种蛋白质形式可以反过来组合形成不同的蛋白质复合物,从而扩大细胞中功能类型。通过新的“组学”筛选技术的发展,分子和模块多样性及其对变化条件的响应的研究直到最近十年才成为可能。
随着基因组时代技术的进步,以及破译细胞分子构成的精确度和分辨率的提高,“一个基因、一个蛋白质、一个功能”的范例显然不能完全解释复杂的功能生物体的表型。在对人类基因组进行测序后,国际人类基因组测序联盟(International human genome sequencing Consortium)报道了约20,000个编码蛋白质的基因,这一数字明显低于之前对基因组的估计。这一发现表明,生物体功能多样性的程度与蛋白质编码基因的数量没有直接关系。这一建议在大规模筛选方法(如全基因组关联研究和RNA干扰筛选)有限的进展中进一步得到证实 深入了解基因型和表型之间的直接联系。虽然单基因缺陷与高外显率被发现使用这些技术,许多研究表型的遗传基础比预期更为复杂,往往是支撑一个基因网络变化或其他机制,涉及其他分子层面,如转录组、蛋白质组和互作组以及它们之间非线性的crosstalk。
与“一个基因,一个蛋白,一种功能”范例相对的,细胞复杂性来自于许多扩展了分子多样性的机制由编码蛋白质的基因组编码的。这些机制包括使用增加编码潜力转录起始位点以及5 '端帽、选择性剪接、选择性聚腺苷酸化和RNA编辑位点共转录或转录后水平。蛋白质的多样性进一步增加使用选择性转录以及翻译过程中的停止密码子。高度的多样化是由翻译后修饰,这包括共价分裂和共价修饰(如磷酸化)。最后,蛋白质可以相互作用相互之间形成多个不同的功能单元,可以潜在地执行各种下游功能。虽然最近的技术进步为转录组、蛋白质组和相互作用组的完全特征化提供了进展它们在任何特定状态下的关系,评估它们的功能影响和表现型都是一个挑战仍有待充分探索。
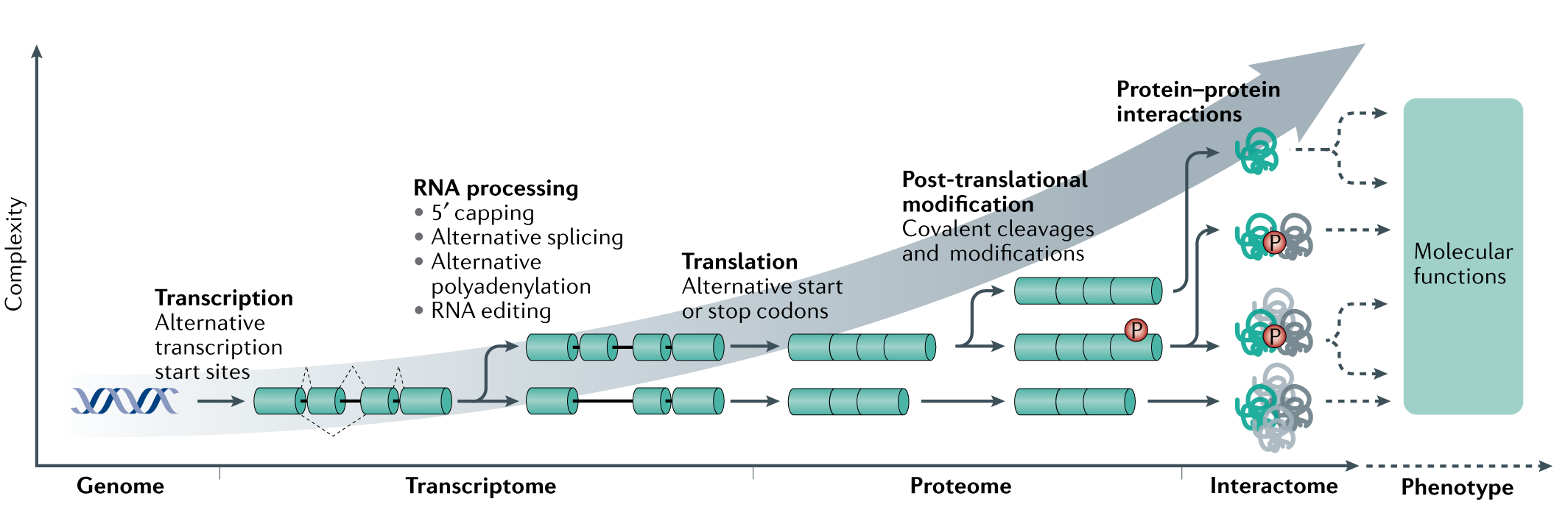
图1
生物系统的蛋白质组由其所有表达的蛋白分子组成,如同转录组一样,同一个生物中不同细胞的蛋白质组差异很大,能够动态适应内外刺激。
虽然蛋白质合成直接依赖于相应的mRNA转录本表达,但转录本浓度以外的因素影响蛋白质表达水平,从而影响细胞的功能。
除了可以直接影响细胞功能,包括其他一些过程增加蛋白质组的多样性。蛋白组的第一水平的多样化可以归因于在翻译过程中使用了可选择性启动或者终止密码子。
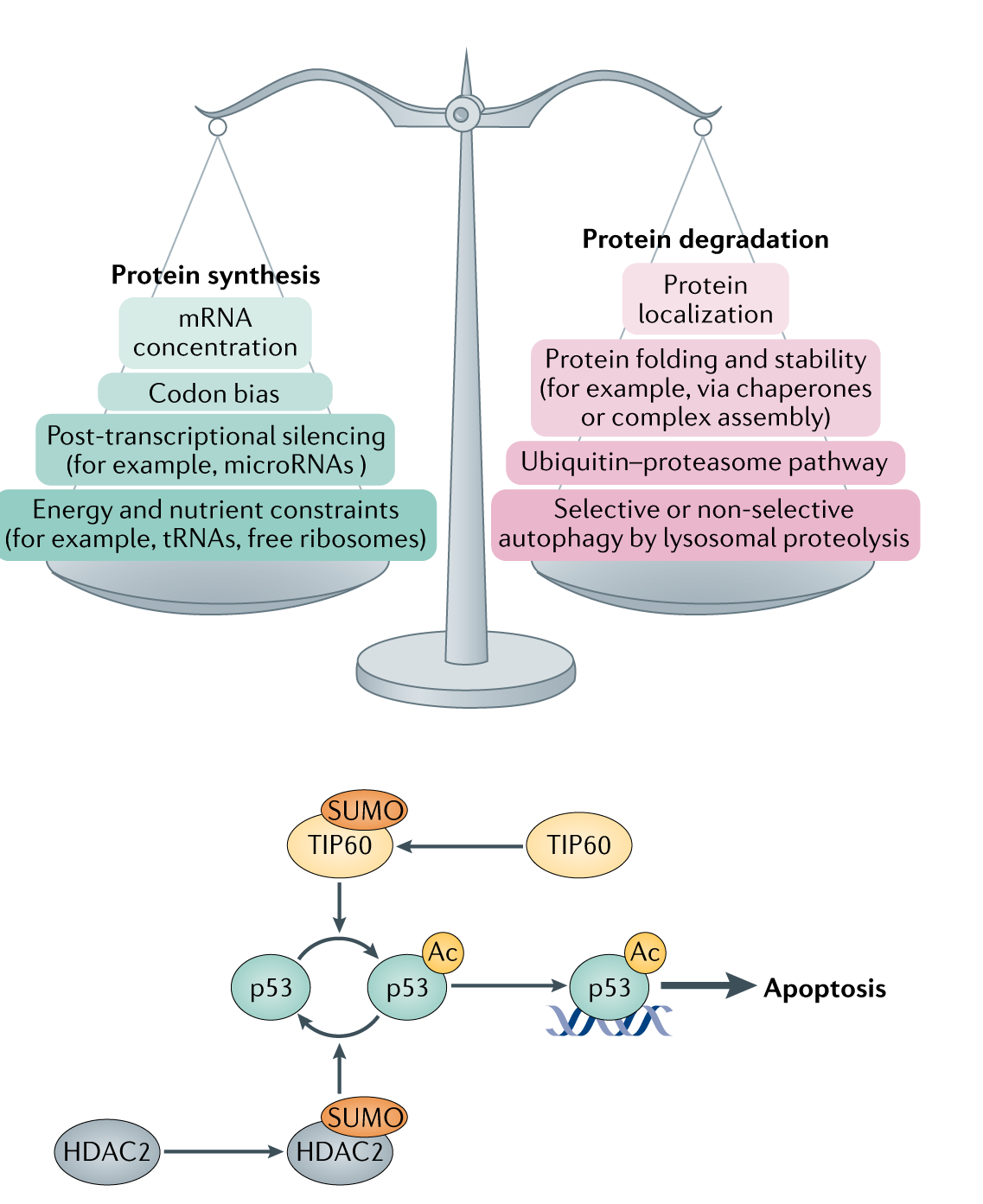
图2
细胞通过多种相互依赖机制紧密调控蛋白质的丰度和功能活性。
a. 稳态是通过蛋白质合成和降解之间的精细平衡来维持的。mRNA转录产物的翻译效率受到密码子偏差的影响,通过转录后调控,如microRNA介导基因沉默,或能量和营养限制,包括tRNAs和免费的核糖体。蛋白质的降解受蛋白质的定位、蛋白质折叠效率的影响(通常需要伴侣或蛋白质结合的过程),泛素介导的降解和溶酶体蛋白水解后选择性和非选择性自噬。 蛋白质组降解速率能够缓冲意外mRNA转录本的丰度变化,如癌症细胞中基因扩增引起的变化。
b. 翻译后修饰对调节蛋白活性很重要,不同蛋白质的翻译后修饰往往不是独立的彼此,例如,肿瘤抑制因子p53启动细胞凋亡的活性,是由乙酰化(http://www.aimsmass.cn/yxhwd.jsp)(Ac)状态调节的。P53的Ac状态和活性增加,是通过乙酰转移酶HDAC2的亚甲基化促进乙酰化合p53的失活。
许多蛋白质作为生化多分子组件功能的一部分;这些组装体形成了大量的分子相互作用,例如蛋白质-DNA,蛋白质-RNA,蛋白质-脂质或蛋白质代谢物的相互作用。细胞中大量的分子相互作用是被称为互作组。
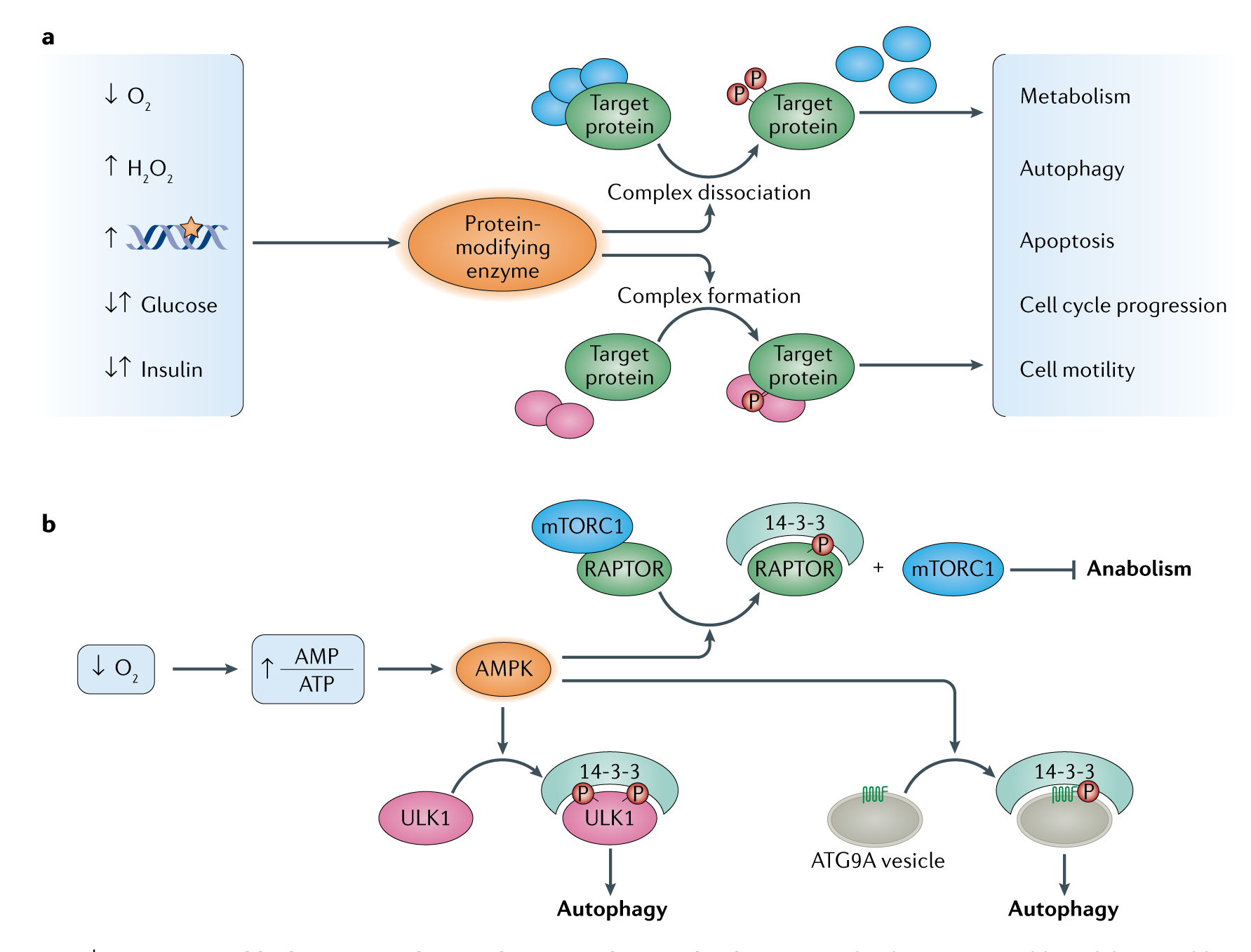
图3
a. 蛋白质复合物的动态组装和拆卸是调节功能多样性的关键机制,通常是特定蛋白形式特有的。当一个细胞暴露在一个变化的条件之下,如缺氧,氧化应激,DNA损伤,营养变化或者其他信号分子的刺激,这通常能导致特殊蛋白质修饰酶的激活。酶的转译后的靶点蛋白特定修饰通常与特定条件的蛋白质复合物的形成或分解有关,通过调节合成代谢和分解代谢之间的适应性转换来影响细胞的功能格局。
b. 蛋白形式的相互作用体的特殊重排,其功能是通过与14-3-3蛋白磷酸化依赖结合而实现。低氧条件下细胞AMP与ATP比值的增加和AMP活化蛋白激酶导致14-3-3蛋白相互作用体的磷酸化依赖重排。AMPK磷酸化RAPTOR,mTORC1蛋白的重要结合伙伴,随后与14-3-3结合,结合之后引起RAPTOR从mTORC1的释放,这会造成mTORC1被抑制和促进合成代谢转变为分解代谢。14-3-3蛋白还与mTORC1下游其他AMPK靶点相互作用,包括ULK1和ATG9A,在饥饿条件下促进自噬维持细胞代谢。
基于上述情况,真核细胞可以产生大量的mRNA异构体。通过NGS可以全面定量这些转录本,然而下面专注于蛋白水平,对最新的蛋白组手段和互作组手段进行了比较。
大多数蛋白质组学研究是基于质谱方法,主要是2种,自上而下和自下而上的蛋白质组学。在自下而上的蛋白质组学中,完整的蛋白质是用色谱法进行分析的,2个完整的蛋白质进入质谱碎片化然后分析,产生独特的碎片化产物通过软件进行分析。然后自上而下的蛋白质组工作流程更为频繁的应用,蛋白质最初是被消化成肽段,然后用液相色谱分离,随后电离后通过串联质谱进行分析,分析器记录下来肽和离子光谱片段。这种自下而上的方法因为在胰酶消化过程中会丢失肽段,因此这是其方法学本身的局限性。
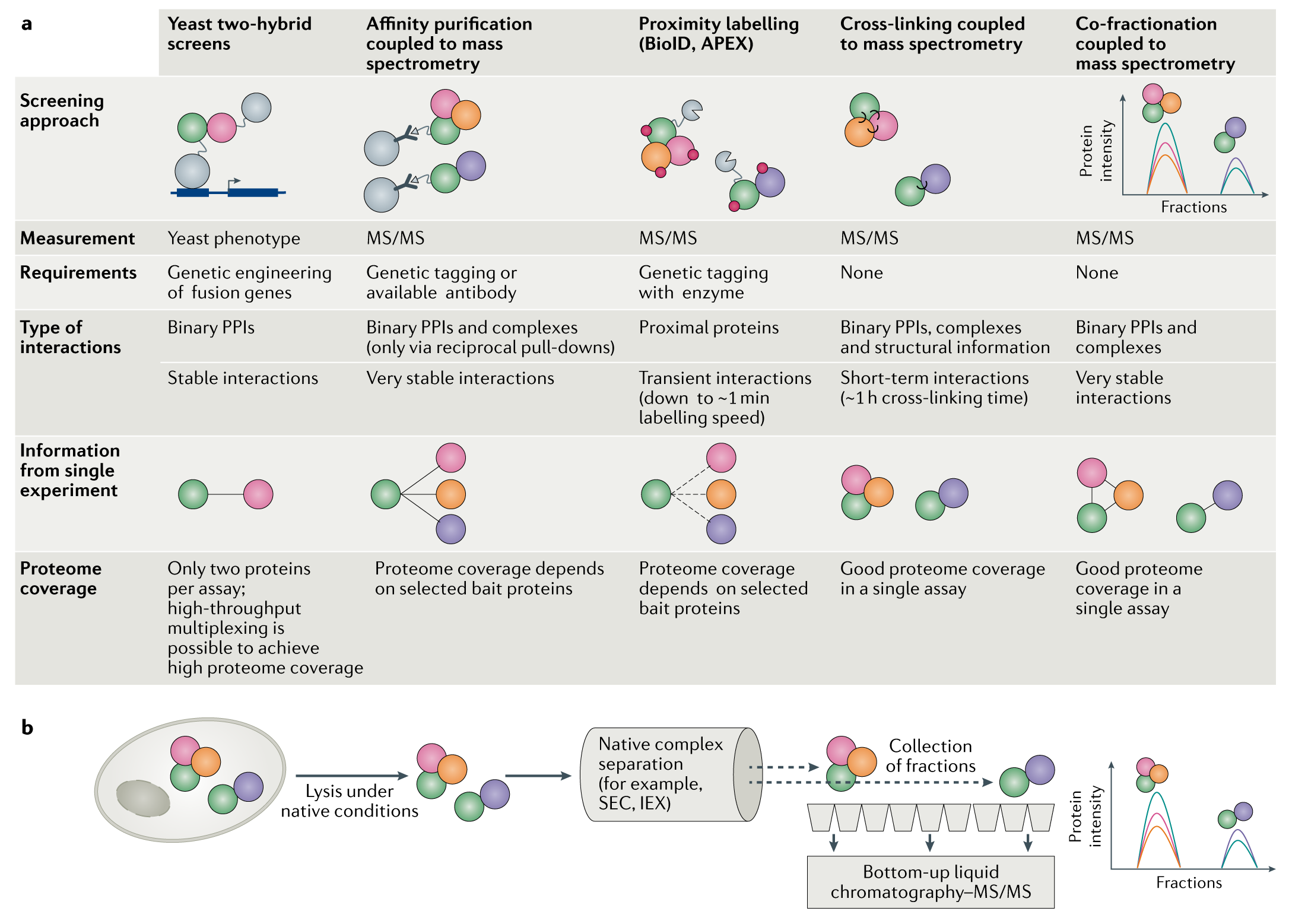
图4
以互补分析和质谱分析为基础的互作组,在过去的几十年里,有几个不同的稳定/瞬时的蛋白质复合物分析方法逐渐发展起来,尽管这些方法中,例如荧光共振能量转移和双分子荧光互补都是基于一个小的蛋白质组的方法,虽然是一种较为小规模的蛋白复合物。目前来看,有5项主要技术使用进行高通量筛选蛋白互作组:酵母双杂筛选(Y2H);AP-MS;APEX;CroFrac-MS和交联蛋白质谱。
a. 传统地,PPIs是通过酵母双杂在培养基的基础上进行研究的策略,随着以质谱为基础的蛋白质组学的发展,亲和纯化与质谱耦合是目前最先进的大规模交互组映射方法。捕捉更多的瞬态互动蛋白,空间接近性标记策略BioID和APEX可用于近距离识别蛋白质时空接近性。交联质谱提供检测蛋白复合物及其结构排列的机会,蛋白质协同分馏与质谱联用技术已成为一种有发展前景的新方法用于从单个分离实验进行检测蛋白复合物。
b. 用于协同分馏结合质谱的细胞,在自然条件下,进行裂解,以保持蛋白质复合物完整。蛋白复合物根据其理化性质被分离和分馏,例如通过SEC色谱或离子交换色谱(IEX)。所有的组分都是分别采用自上而下的分析方式,蛋白复合物可以从色谱中洗脱的组分中被区分出来,图中实线表示处理步骤顺序,虚线表示分离过程。
虽然蛋白质复合物的信息能够提供对其功能的评估,但是仍然缺乏直接探究功能性的方法。随着组学手段的进一步改进以及收敛和整合,在不久的将来,如自上向下或自下向上的蛋白质方法可以推断出大部分蛋白复合体的形式。
文献出处:Proteomic and interactomic insights into the molecular basis of cell functional diversity
Aimsmass---蛋白质谱服务,提供快速便捷的溶液质谱鉴定服务